12
März 2016
BDI aktuell
Medizin
Mehr als 80000 Menschen in
Deutschland sind bei endgradiger Nie-
reninsuffizienz auf Dialyse angewiesen.
Warum entscheiden sich 95 Prozent
für die Behandlung in Dialyse-Zentren
statt für die Peritonealdialyse? Welche
psychosozialen Faktoren beeinflussen
diese Entscheidung und was hat der
behandelnde Arzt damit zu tun? Gibt
es Möglichkeiten, die Behandlungszu-
friedenheit der Patienten durch Opti-
mierung der Beratung zu verbessern?
Diese Fragen will das Projekt CO-
RETH an der Medizinischen Fakultät
in Halle beantworten, teilt die Univer-
sität Halle-Wittenberg mit. Nach den
bereits vorliegenden ersten Ergebnis-
sen hat der behandelnde Nephrologe
einen starken Einfluss auf die Thera-
pieentscheidung. Dessen Wissensstand
sowie die Einstellung zur Peritoneal-
dialyse präge die Wahl des Patienten
für die eine oder die andere Methode.
Des Weiteren wurde herausgefunden,
dass sich Patienten mit Peritonealdia-
lyse häufig besser und intensiver infor-
miert fühlen als Patienten mit Hämo-
dialyse, heißt es in der Mitteilung.
Als Gründe für die Entscheidung
zur Peritonealdialyse gab die Mehrzahl
der Patienten die größere Unabhän-
gigkeit an. Ein Viertel der Zentrums-
dialysepatienten kreuzte an, dass die
Wahl hauptsächlich durch ihren Arzt
getroffen worden sei. Ein Fünftel hatte
sich für diese Variante entschieden,
weil die Betroffenen auf die medizini-
sche Unterstützung im Dialysezent-
rum zählen wollten. Alle Patienten wa-
ren zufriedener, wenn sie die Entschei-
dung gemeinsam mit ihrem Arzt tref-
fen konnten.
Die Ergebnisse des zweiten und
dritten Teils der Studie sind für An-
fang 2016 zu erwarten. Teil 2 der Be-
fragung ist darauf ausgerichtet, heraus-
zufinden, welche Begleiterkrankungen
ein Proband hat und welche Beein-
trächtigungen damit einhergehen.
(eb)
Erste Ergebnisse der Studie
CORETH zur Verbesserung
der Therapie chronisch
Nierenkranker liegen vor.
Studie zur Versorgung von Dialysepatienten
Im Frühjahr 2015 stellte sich ein 51-
jähriger Patient mit seit 08/13 aufge-
tretenen druckdolenten, prätibialen
Ödemen, Uhrglasnägeln und Trom-
melschlegelfingern vor. Nach Ibupro-
fen gingen die Knieschmerzen nur
unzureichend zurück, eine Arthrosko-
pie zur Abklärung der Gonalgien
konnte die Beschwerden nicht lindern.
Die kardiologische Diagnostik war un-
auffällig.
Körperliche Untersuchung
Bei der Erstvorstellung zeigte sich der
Patient im guten Allgemein- und
Ernährungszustand. Es fielen prätibia-
le Ödeme, Schwellungen beider oberer
Sprunggelenke (OSG), Trommelschle-
gelfinger und Uhrglasnägel auf.
Apparative Diagnostik
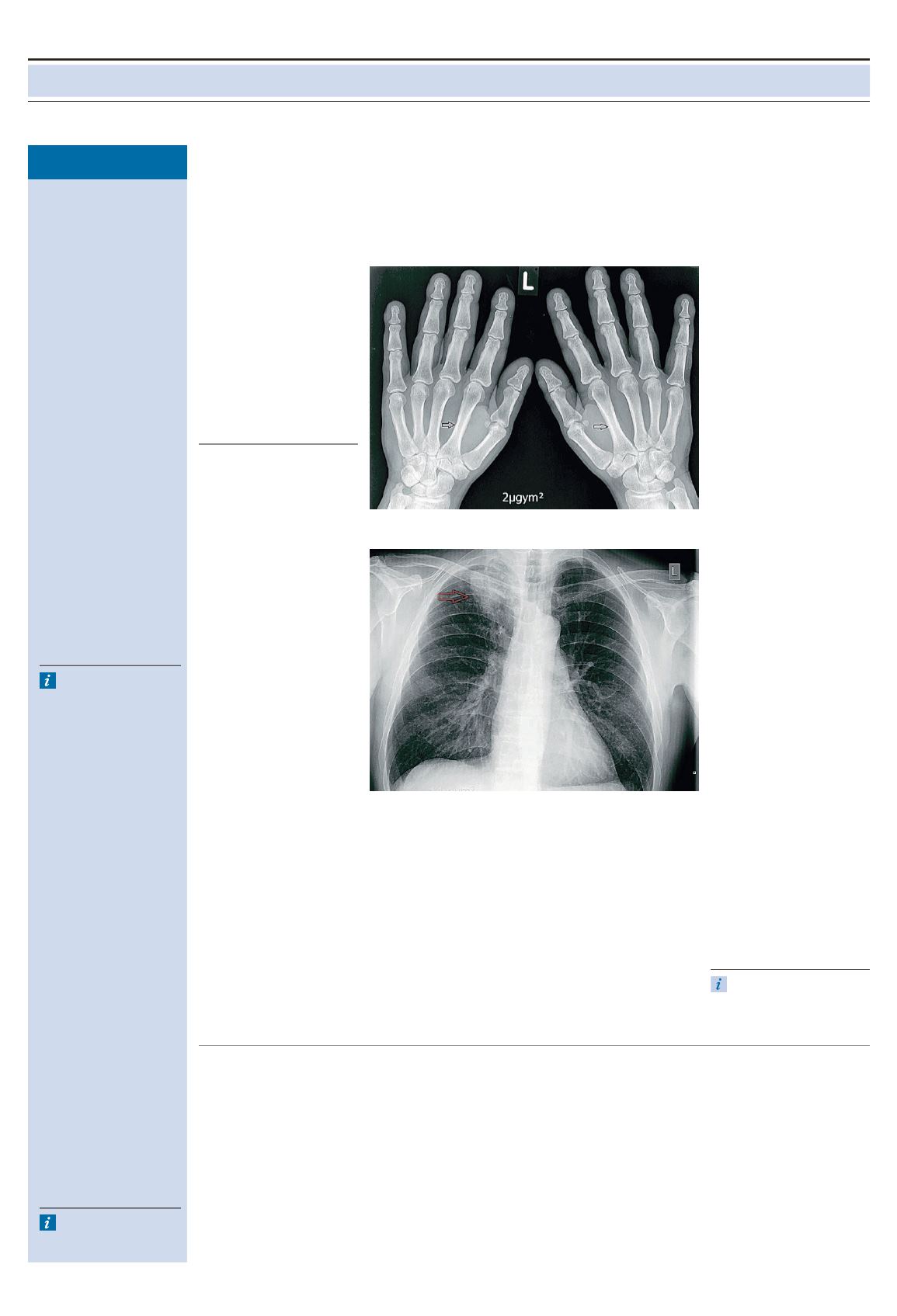
Röntgen der Hände: normale Minera-
lisation, normale Gelenkspaltweiten,
keine Erosionen, periostale Verdickun-
gen an einzelnen Diaphysen (Abb. 1).
Thoraxröntgenaufnahme: Raumforde-
rung rechter Oberlappen, verdächtig
auf ein Karzinom (Abb. 2). Labor-
diagnostik: CEA 16,5 ng/ml ( 5).
Diagnose und Therapie
Zusammenfassend bestand bei seit
etwas über einem Jahr neu aufgetrete-
nen Uhrglasnägeln, Trommelschlegel-
fingern und prätibialen, schmerzhaften
Schwellungen der Verdacht auf eine
hypertrophe Osteoarthropathie (HOA,
Marie-Bamberger-Syndrom). Zur wei-
teren Abklärung wurde eine Röntgen-
aufnahme des Thorax veranlasst, in
dem sich der Verdacht auf ein Bron-
chialkarzinom im rechten Oberlappen
zeigte. Der Patient stellte sich wenige
Tage später in einer Lungenfachklinik
vor, in der nach bioptischer Sicherung
ein Adenokarzinom der Lunge diag-
nostiziert werden konnte.
Diskussion
Die sekundäre hypertrophe Osteoarth-
ropathie (Marie-Bamberger-Syndrom)
tritt mit einer Inzidenz von bis zu 5
Prozent bei Patienten mit nichtklein-
zelligem Bronchialkarzinom (NSCLC)
auf. Lungenmetastasen, zystische Fi-
brose, ein Pleuramesotheliom oder ein
Morbus Hodgkin können ebenfalls zu-
grunde liegen wie auch kongenitale
Herzerkrankungen oder Erkrankungen
des Gastrointestinaltrakts. Typische
Symptome sind Trommelschlegelfin-
ger sowie Knochen- und Gelenk-
schmerzen. Dieses paraneoplastische
Syndrom tritt zeitlich vor typischen
Tumorsymptomen auf und kann auch
mithilfe der Skelettszintigraphie weiter
abgeklärt werden. Wird die Symptom-
konstellation Trommelschlegelfinger
und Knochenschmerz frühzeitig er-
kannt, lässt sich ein Bronchialkarzi-
nom in einem früheren Tumorstadium
diagnostizieren. Im Gegensatz dazu
tritt die familiäre oder idiopathische
hypertrophe Osteoarthropathie (Tou-
raine-Solent-Golé-Syndrom, Pachy-
dermoperiostose) in der Pubertät auf
und ist nicht mit anderen zugrunde
liegenden Krankheiten assoziiert.
Die Pathogenese der HOA ist un-
bekannt. Man findet Monozyteninfilt-
rate in den angrenzenden Weichteilen
und eine Proliferation des Bindegewe-
bes am Nagelbett und an den Finger-
sowie Zehenkuppen, sodass die dista-
len Phalangen trommelschlegelartig
wirken. Die Kapillaren in den Trom-
melschlegelfingern sind erweitert mit
Verdickung der Gefäßwand. Zusätzlich
ist die Anzahl der arteriovenösen An-
astomosen erhöht. Die Synovialis der
beteiligten Gelenke kann Lymphozy-
ten- und Plasmazellinfiltrate aufwei-
sen. Diskutiert wurden sowohl humo-
rale und neurogene Theorien.
Einige Substanzen wie Östrogene,
Prostaglandine, Bradykinin, Ferritin
und „platelet-derived growth factor“
(PDGF) wurden als Mediatoren der
HOA diskutiert. Eine andere Hypo-
these geht von einer Produktion und
Freisetzung von vaskulären endothe-
lialen Wachstumsfaktoren (VEGF)
durch den Tumor aus, der die Merk-
male der HOA wie Gefäßproliferation,
Ödembildung und Knochenneubil-
dung fördert. In zwei Fallberichten
von Patienten mit Bronchialkarzinom
und HOA wurden erhöhte Konzentra-
tionen von zirkulierenden VEGF
nachgewiesen, die im Tumor produ-
ziert wurden (Anticancer Res 2002
22:3485; J Rheumatol 2004; 31:614).
In einem Fall wurden nach Resektion
des Tumors ein deutlicher Rückgang
der VEGF-Konzentration und ein Ver-
schwinden der Skelettanomalien beob-
achtet (J Rheumatol 2004; 31:614).
Seit Längerem ist bekannt, dass
eine Vagotomie zur Rückbildung der
HOA-Symptome führen kann (JAMA
1962; 11: 555–557, Ann Thora Surg
2007; 83: 684–685). Es wird ange-
nommen, dass ein neuraler Reflex, der
durch eine vagale Stimulation vom Er-
krankungsort aus initiiert wird, die Va-
sodilatation und andere typische
Symptome der HOA auslöst. Weitere
Untersuchungen sind notwendig, um
diesen Zusammenhang ähnlich wie bei
der rheumatoiden Arthritis (Best Pract
Res
Clin
Rheumatol
2014;
28:625–635;
Mol
Med
2011;
17:937–948) therapeutisch nutzen zu
können.
Dieser Beitrag von Dr. Ingo Hartig, Ina
Matveeva und Dr. Matthias Braun, HELIOS
Seehospital Sahlenburg Cuxhaven, wurde
bereits veröffentlicht in der Zeitschrift für
Rheumatologie 2015; 74: 728-730
Die Symptomkonstellation
aus Trommelschlegelfingern
und Knochenschmerz kann
auf ein Marie-Bamberger-
Syndrom hindeuten. Wird
es frühzeitig erkannt, lässt
sich ein Bronchialkarzinom
in einem früheren Stadium
diagnostizieren.
Trommelschlegelfinger: Ist es
ein Marie-Bamberger-Syndrom?
Von Dr. Ingo Hartig, Ina Matveeva und
Dr. Matthias Braun
Abbildung 1: Periostale Hypertrophie an Diaphysen der Metakarpalia und Phalangen.
© SPRINGER VERLAG GMBH
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
5%
mit dieser Inzidenz
tritt das Marie-
Bamberger-Syndrom bei Patienten
mit nicht-kleinzelligem Bronchial-
karzinom auf.
Abbildung 2: Weichteildichte Verschattung in Projektion auf rechten Lungenoberlappen.
© SPRINGER VERLAG GMBH
Lesetipp
Sowohl im Kindes- als auch im Er-
wachsenenalter führt das Tumorly-
sesyndrom (TLS) gehäuft nach Ein-
leitung einer Chemotherapie zu me-
tabolischen Veränderungen und Or-
gandysfunktionen. Der Schlüssel je-
des TLS-Managements liegt in der
Prävention. An das jeweilige TLS-
Risiko adaptiert werden Maßnah-
men 24 h vor Induktionstherapie
eingeleitet. Die Basistherapie bildet
die i.v.-Hydrierung, ergänzt je nach
Risikoprofil um Allopurinol oder
Rasburicase. Elektrolytentgleisun-
gen sollten symptomkorreliert thera-
piert werden, v. a. bei Hypokalzämie
und einem Kalzium-Phosphat-Pro-
dukt
.
60 mg
2
/dl
2
. Bei manifestem
TLS mit progredientem Nierenversa-
gen oder konservativ nicht be-
herrschbaren Elektrolytentgleisun-
gen ist die Indikation zur Nierener-
satztherapie großzügig zu stellen.
Sowohl Hyperurikämie, Hyperphos-
phatämie als auch Hyperxanthin-
ämie können eigenständig ein aku-
tes Nierenversagen induzieren.
Das primäre Ziel ist die Vermei-
dung eines manifesten TLS mit kon-
sekutivem Nierenversagen. Letzte-
res kompromittiert die körpereige-
nen Kompensationsmechanismen
entscheidend und aggraviert das Er-
krankungsbild. Unter Rasburicase-
Therapie spielt vor allem das durch
Kalzium-Phosphat-Ablagerungen in-
duzierte Nierenversagen eine ent-
scheidende Rolle. Suffizient behan-
delt, ist jedes Nierenversagen rever-
sibel.
Nusshag C et al. Das Tumorlysesyn-
drom - Mehr als ein Hyperurikämie-
induziertes akutes Nierenversagen.
Nephrologe 2016; 11: 6-13
Das akut-auf-chronische Leberver-
sagen (ACLF) stellt eine relativ neue
Entität dar, dessen Diagnosekriteri-
en erst in den letzten Jahren näher
definiert wurden. Es beschreibt eine
akute hepatische Dekompensation
einer präexistenten chronischen
Lebererkrankung mit konsekutivem
Organversagen und sehr schlech-
tem, stadienabhängigen Kurzzeit-
überleben. Es muss von einer aku-
ten Dekompensation ohne Organver-
sagen und dem akuten Leberversa-
gen scharf abgegrenzt werden. Bak-
terielle Infekte sind wichtige Trigger
und induzieren eine fatale dysregu-
lierte Immunantwort, die zu einer
systemischen Inflammation führt.
Die sequenzielle Abfolge von Hyper-
inflammation und Immunparalyse
führt häufig zum Tod aufgrund nicht
beherrschbarer Organschäden und
sekundärer Infektionen. Die renale
Dysfunktion hat hierbei einen es-
senziellen Einfluss auf die Progno-
se, da ein alleiniges Nierenversagen
bereits die 30-Tages-Mortalität
deutlich verschlechtert. Versagen
mehrere Organe, überleben weniger
als 50%. Neben der Behandlung
des auslösenden Ereignisses und in-
tensivmedizinischer Maßnahmen ist
therapeutisch die Lebertransplanta-
tion effektiv, wobei der Organman-
gel einen limitierenden Faktor dar-
stellt. Experimentelle Therapiever-
fahren wie die Albumindialyse oder
der Einsatz von G-CSF müssen in
weiteren Studien validiert werden.
Zimmermann H W et al. Akut-auf-
chronisches Leberversagen – Eine
neue Entität. Gastroenterologe 2016;
11: 28-33
Das Tumorlysesyndrom
Akut-auf-chronisches
Leberversagen


