Medizin
Nr. 2 • Februar 2014
12
▶ es sich um ein Rezidivereignis han-
delt,
▶ die Lokalisation atypisch ist,
▶ die Familienanamnese positiv ist ,
▶ eine Schwangerschaft vorliegt,
▶ die Patientin mehr als zwei Aborte
hatte.
Ist der Patient zum Zeitpunkt des Erst-
ereignisses zwischen 45 und 60 Jahre
alt, reicht neben dem Basisscreening
die Bestimmung der APC-Resistenz
und der Prothrombinmutation.
Bei einem Alter über 60 Jahren zum
Zeitpunkt des Erstereignisses ist keine
weitere Thrombophiliediagnostik
erforderlich [25].
Betrachtet man die prädisponierenden
Faktoren nach ihrem Risiko, liegt ein
hohes Risiko mit einer Odds-Ratio
(OR) von über 10 bei Frakturen der
Hüfte und des Beines vor. Auch große
chirurgische Eingriffe sowie große
Traumata und Wirbelsäulenverletzun-
gen gehören in diese Risikogruppe.
Ein mittleres Risiko mit einer OR zwi-
schen 2 und 9 liegt bei einer arthro-
skopischen Knie-Operation, nach
Anlage eines zentralvenösen Kathe-
ters, bei einer chronischen Herzinsuf-
fizienz, nach einer Chemotherapie,
bei einer Malignomdiagnose, bei einer
Therapie mit oralen Kontrazeptiva,
bei einer Immobilität nach Schlagan-
fällen, bei Schwangerschaft peripartal,
bei vorangegangenen venösen Throm-
bembolien sowie bei Thrombophilie
vor.
Ein niedriges Risiko mit einer OR
unter 2 liegt bereits bei einer Bettruhe
vor, die länger als 3 Tage andauert.
Auch ein erhöhtes Alter gehört in
diese Gruppe wie Übergewicht und
laparoskopische Operationen [23].
Venöse Thrombembolien treten bei
ca. 20% der Krebspatienten auf und
sind in dieser Patientengruppe die
zweithäufigste Todesursache [5].
Ebenso sind ca. 15% der Patienten mit
venösen Thrombembolien Tumorpa-
tienten. Deshalb sollte bei der Erstdi-
agnose einer venösen Thrombembolie
ein Karzinom-Screening in Erwägung
gezogen werden. Häufig liegen Karzi-
nome folgender Organe vor: Pankreas,
Lungen, Magen, Kolon, Ovar- oder
Uterus und Prostata.
kurzgefasst
Man unterscheidet erworbene
und genetische Risikofaktoren, die
unterschiedlich stark für eine VTE
prädisponieren. Zur Einleitung der
Thrombophiliediagnostik sind das
Patienten- alter zum Zeitpunkt des
Erstereignisses und das Rezidivereig-
nis maßgeblich.
Diagnostik der venösen
Thrombembolie
Beim diagnostischen Vorgehen ist
zunächst zu klären, ob der Patient
hämodynamisch stabil ist, in der Regel
also ein niedriges klinisches Risiko hat,
oder ob der Patient klinisch instabil ist
und somit ein hohes Risiko hat.
Bei hämodynamisch stabilen
Patienten
Beim hämodynamisch stabilen Patien-
ten muss zunächst die klinische
Wahrscheinlichkeit einer Lungenem-
bolie verifiziert werden. Dies kann
unter Zuhilfenahme von Wahrschein-
lichkeitsscores wie dem revidierten
Genf-Score oder dem Wells-Score
geschehen [14, 24].
Bei einer hohen klinischen Wahr-
scheinlichkeit wäre der nächste diag-
nostische Schritt das Anfertigen einer
Multislice-Spiral-CT-Angiographie
(CTA). Die CTA gilt aktuell als der
„Gold-Standard“ der Diagnostik von
Thrombembolien (Abb. 1, Abb. 2).
Ist die klinische Wahrscheinlichkeit
niedrig oder intermediär, sollte ein
D-Dimere-ELISA-Test durchgeführt
werden. Bei positivem D-Dimere-Test
wäre ebenfalls die CTA angezeigt [8].
D-Dimere entstehen als Endprodukt
bei der Proteolyse des Fibrins. Der
Anstieg des D-Dimers im Plasma ist
Folge der Aktivierung der Blutgerin-
nung und der damit einhergehenden
Fibrinolyse. Prinzipiell sollte ein D-
Dimere-Test aber nur nach vorheriger
Einschätzung der klinischen Wahr-
scheinlichkeit durchgeführt werden.
Bei niedriger klinischer Wahrschein-
lichkeit und normalen D-Dimeren ist
keine weitere Lungenembolie-Diag-
nostik erforderlich. Bei hoher klini-
scher Wahrscheinlichkeit ist die
Bestimmung der D-Dimere entbehr-
lich [3].
kurzgefasst
Diagnostisches Vorgehen bei
Verdacht auf eine venöse Thrombem-
bolie:
▶ Hohe Wahrscheinlichkeit: CTA
▶ Niedrige Wahrscheinlichkeit: wenn
D-Dimere positiv, dann CTA; wenn
D-Dimere negativ, VTE ist ausge-
schlossen
Bei hämodynamisch instabilen
Patienten
Bei hämodynamisch instabilen Patien-
ten muss zunächst geklärt werden, ob
eine akute rechtsventrikuläre Dys-
funktion vorliegt. Dieses kann durch
eine transthorakale Echokardiogra-
phie oder eine CTA erfolgen. Liegt in
der transthorakalen Echokardiogra-
phie keine Rechtsherzbelastung vor,
kann die Diagnostik wie oben
beschrieben fortgeführt werden. Bei
akuter rechtsventrikulärer Dysfunkti-
on oder positiver CTA muss unmittel-
bar eine Behandlung erfolgen.
Allerdings sollte die gerinnungshem-
mende Therapie nicht durch den the-
rapeutischen Algorithmus verzögert
werden. Die bettseitige transthorakale
Echokardiographie gehört zur Basisdi-
agnostik bei massiver Lungenembolie
bzw. hämodynamischer Instabilität.
Als echokardiographische Kriterien
der Rechtsherzbelastung gelten [6]:
▶ Rechtsventrikuläre abnorme Wand-
bewegung
▶ Rechtsventrikuläre Dilatation
▶ Paradoxe Septumbeweglichkeit
▶ Trikuspidalinsuffizienz mit erhöh-
tem pulmonalarteriellem Druck
▶ Stauung der Vena cava inferior
▶ Dilatierte Pulmonalarterien
Weiterhin markieren das erhöhte
Mortalitätsrisiko der VTE ein Anstieg
des Troponin-I- oder -T-Werts sowie
die Erhöhung des BNP- oder nt-pro-
BNP-Werts [23].
Die Kombination der Bestimmung des
RV/LV Volumens mittels CTA und der
Biomarker nt-pro-BNP oder Troponin I
verbessern die diagnostische Aussage-
kraft [9].
Bei negativem CTA-Befund und wei-
terhin bestehendem Verdacht auf Lun-
genembolie sind weitere Verfahren
wie Duplexsonographie der Beinvenen
und Lungenszintigraphie angezeigt.
kurzgefasst
Diagnostik zur Risikostratifizie-
rung bei venöser Thrombembolie:
▶ CTA mit Bestimmung des RV/LV
Volumens
▶ Transthorakale Echokardiographie
zur Bestimmung der Rechtsherzbe-
lastung
▶ Biomarkerbestimmung: Troponin I
oder T, BNP oder nt-pro BNP
Risikoadaptierte Thera-
pie der Lungenembolie
In der Therapie der akuten Lungenem-
bolie ist die Auswahl des Therapiever-
fahrens abhängig vom Risikoprofil und
der hämodynamischen Stabilität des
Patienten. Bei einem hohen Risiko und
hämodynamischer Instabilität besteht
die Indikation zur systemischen
Thrombolyse. Bei einem mittleren
Risiko folgt eine Antikoagulation, in
ausgewählten Fällen ggf. auch eine
systemische Thrombolyse. Bei einem
niedrigen Risikoprofil reicht eine Anti-
koagulation wie bei der Beinvenen-
thrombose. Bei Patienten mit niedri-
gem Risiko, welches zum Beispiel mit
den Hestia-Kriterien diskriminiert
werden kann, kann die Behandlung
einer Lungenembolie auch ambulant
erfolgen [27]. Allerdings ist die ambu-
lante Behandlung der Lungenembolie
nicht unumstritten [26].
In der PEITHO-Studie, die 1006 Patien-
ten mit VTE einschloss, konnte bei
normotensiven VTE-Patienten mit
intermediären Risiko durch die Gabe
von Tenecteplase im Vergleich zu Pla-
cebo das Mortalitätsrisiko und das
Risiko eines hämodynamischen Kol-
laps durch die VTE signifikant gesenkt
(p=0,015). Dies allerdings unter
Inkaufnahme eines signifikant erhöh-
tem Blutungsrisiko vor allem in der
Gruppe der über 75-Jährigen [14].
Thrombolysetherapie bei hohem
Risiko
Zur Thrombolysetherapie stehen aktu-
ell drei Substanzen zur Verfügung.
▶ Alteplase (rt-PA): 10 mg Bolus, app-
liziert über 1 – 2 min, gefolgt von
90 mg über 2 Stunden (bei Gewicht
unter 65 kg 1,5 mg/kg Körperge-
wicht)
▶ Urokinase: appliziert in einer Dosis
von 3 Mio. Einheiten über 2 Stun-
den
▶ Streptokinase: appliziert einer Dosis
von 1,5 Mio. Einheiten über 2 Stun-
den [8].
Bei der Anwendung einer Thromboly-
setherapie muss zuvor eine sorgfältige
Nutzen-Risiko-Abwägung unter
besonderer Berücksichtigung des Risi-
kos der fatalen Hämorrhagie erfolgen
[12].
Antikoagulation bei niedrigem und
mittlerem Risiko
Bei der Antikoagulanzientherapie bei
akuter Lungenembolie unterscheidet
man die Akut-, die Erhaltungs- und
die Dauertherapie. Bisher kamen drei
Therapievariationen zum Einsatz.
1. Akuttherapie: unfraktioniertes
(UFH) oder niedermolekulares
Heparin (NMH) Erhaltungs- und
Dauertherapie: überlappende Gabe
eines Vitamin K-Antagonisten (VKA)
2. Akuttherapie: UFH oder NMH Zwi-
schenschritt: weitere Gabe von
NMH (z.B. aufgrund von invasiven
diagnostischen Überlegungen) Dau-
ertherapie: überlappende Umstel-
lung auf VKA
3. Akuttherapie: UFH oder NMH Erhal-
tungs- und Dauertherapie: NMH
Diese Therapieform kommt vor
allen bei Tumorpatienten zum Ein-
satz [7].
Bei VKA handelt es sich um bewährte
Substanzen mit einem niedrigen Preis,
die oral verabreicht werden können.
Als nachteilig hat sich der schwanken-
de Blutspiegel, die erforderlichen häu-
figen laborchemischen Kontrollen und
die ständigen Dosisanpassungen
erwiesen. Nachteilig bei VKA sind
sicherlich auch die Folgekosten z.B.
durch Blutungen bei zu hoher Einstel-
lung und Thrombembolie-Rezidive bei
zu niedriger Einstellung.
Bei niedermolekularen Heparinen
handelt es sich auch um bewährte
Substanzen, die in der Regel nicht
laborchemisch kontrolliert werden
müssen. Vorteilhaft ist auch die rasche
Wirksamkeit. Der Nachteil liegt in der
subkutanen Injektion. Problematisch
sind die Applikation bei Niereninsuffi-
zienz und der relativ hohe Preis.
kurzgefasst
Das Therapieschema der VTE
richtet sich nach dem Risikoprofil des
Patienten:
▶ Hohes Risiko: Thrombolysetherapie
▶ Mittleres Risiko: Antikoagulation, in
ausgewählten Fällen Thrombolyse
▶ Niedriges Risiko: Antikoagulation
Direkte orale Antikoagulanzien in der
Therapie der stabilen Lungenembolie
Bei den neuen oralen Antikoagulan-
zien handelt es sich zum einen um
Substanzen, die direkt den Faktor Xa
inhibieren (Apixaban und Rivaroxa-
ban), zum anderen um einen direkten
Thrombinantagonisten (Dabigatran).
Die EINSTEIN-PE-Studie.
In der EINSTEIN-PE-Studie wurde die
Wirksamkeit von Rivaroxaban im Ver-
gleich zur Kombination Heparin und
VKA untersucht. 4832 Patienten mit
bestätigter symptomatischer Lunge-
nembolie und/oder symptomatischer
tiefer Beinvenenthrombose wurden
aufgenommen. Es handelte sich um
eine randomisierte, offene, ereignisge-
steuerte Nicht-Unterlegenheitsstudie
für 3, 6 oder 12 Monate Therapie. Der
primäre Endpunkt war das erneute
Auftreten einer Thrombembolie. Im
Beobachtungszeitraum von 360 Tagen
zeigte sich in der Rivaroxaban-Gruppe
keine Unterlegenheit im Vergleich zur
Enoxaparin/VKA-Gruppe (p=0,003).
Betrachtet man allerdings den primä-
ren Sicherheitsendpunkt, die schwere
und nicht-schwere klinisch relevante
Blutung, zeigten sich nach 360 Tagen
signifikant weniger Ereignisse in der
Rivaroxaban-Gruppe. In der Subgrup-
pe der schweren Blutungen wird im
Beobachtungszeitraum der Vorteil von
Rivaroxaban im Vergleich zu Enoxapa-
rin/VKA noch deutlicher (p=0,003).
Die Untersucher schließen daraus,
dass Rivaroxaban bei besserem Nut-
zen-Risiko-Profil initial und in der
Dauertherapie der Standardtherapie
nicht unterlegen ist [4].
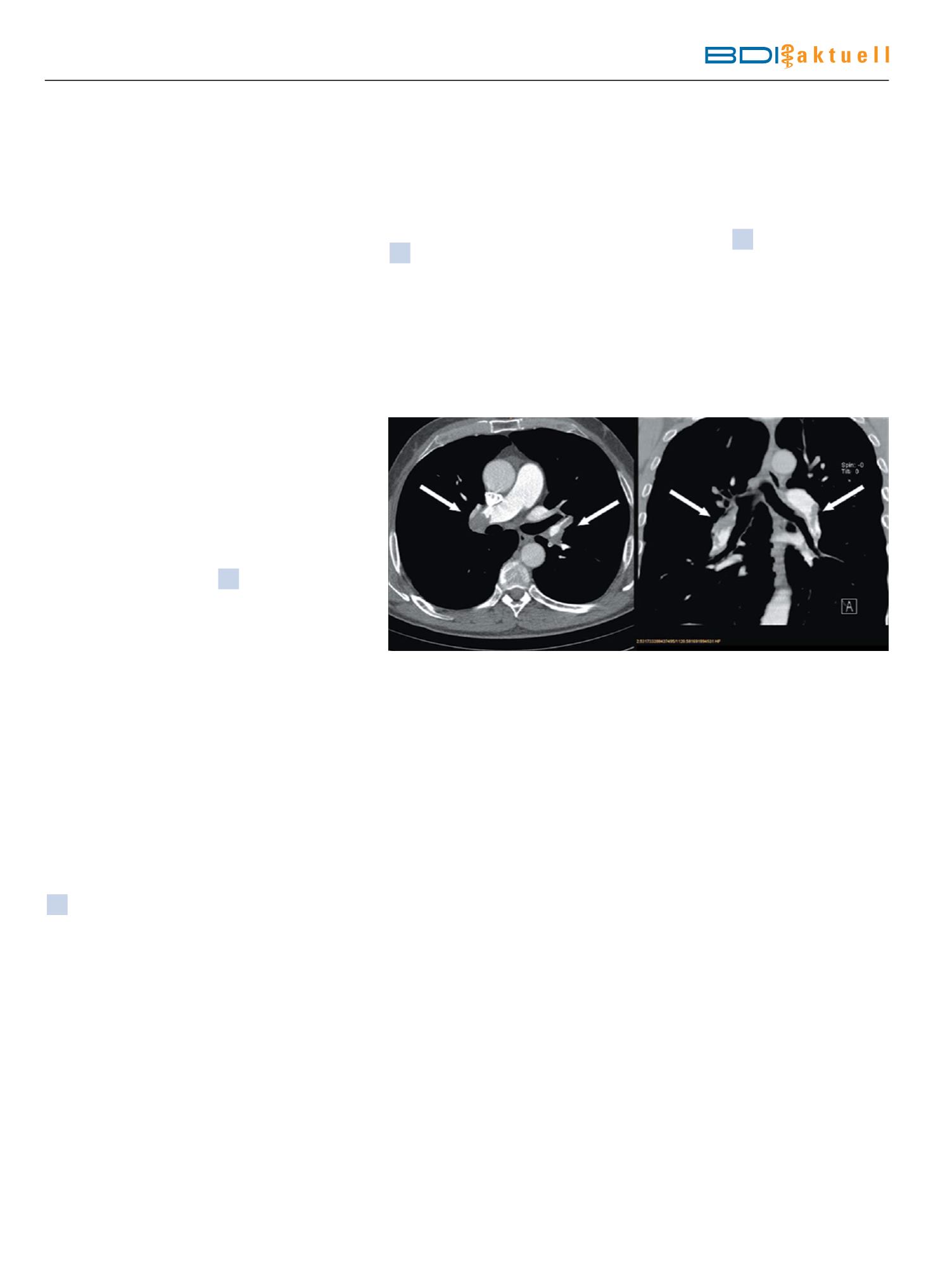
Abb.1
CT-Angiographie der Lunge: Axiale (links) und koronare (rechts) Bildrekonstruktion. Intraluminaler Thrombusnachweis mit Fül-
lungsdefekten (weiße Pfeile) im Bereich der rechten und linken Lungenarterie [15].


