Medizin
Nr. 2 • Februar 2014
15
Nach mechanischem Ersatz von Mit-
ral- und/oder Aortenklappe ist die
Antikoagulation mit Dabigatran im
Vergleich zu Warfarin mit einer
erhöhten Blutungsneigung und ver-
mehrten thrombembolischen Ereig-
nissen verbunden. Zu diesem Ergeb-
nis kommt die 12-wöchige, offene,
multizentrische, prospektive Phase-
II-Dosisfindungsstudie RE-ALIGN
(Randomized Phase II Study to Eva-
luate the Safety and Pharmacokine-
tics of Oral Dabigatran Etexilate in
Patients after Heart Valve Replace-
ment). Insgesamt nahmen 252
Patienten teil.
Die Patienten, bei denen die Implan-
tation einer mechanischen Aorten-
und/oder Mitralklappe maximal
7 Tage bzw. mindestens 3 Monate
(Population A bzw. Population B)
zurücklag, wurden im Verhältnis 2:1
einer Behandlung mit Dabigatran
(n=168) oder Warfarin (n=84) zuge-
wiesen. Im Dabigatran-Arm lag die
Anfangsdosis abhängig von der Nie-
renfunktion bei 150 mg, 220 mg
oder 300 mg 2× täglich. Die Dosis
wurde anschließend so angepasst,
dass ein Dabigatran-Talspiegel von
mindestens 50 ng/ml erreicht wurde.
Warfarin wurde so dosiert, dass
abhängig vom thrombembolischen
Risiko eine International Normalized
Ratio (INR) von 2–3 oder 2,5–3,5
(niedriges oder mittleres bzw. hohes
Thrombembolierisiko) bestand.
Beurteilt wurde die Zeit mit einem
Dabigatran-Spiegel im Zielbereich
sowie als klinische und Sicherheits-
endpunkte die Häufigkeit von
thrombembolischen Ereignissen und
Blutungen.
Die Studie wurde frühzeitig abgebro-
chen, da in der Dabigatran-Gruppe
die Rate an thrombembolischen und
Blutungs-Ereignissen erhöht war.
Unter Dabigatran war bei 9 Patienten
(5%) ein Schlaganfall und bei
3 Patienten (2%) ein akuter Myokard-
infarkt aufgetreten. In der Warfarin-
Gruppe war dies bei keinem Patien-
ten der Fall. Ferner war es im Dabi-
gatran-Arm bei 7 (4%) und in der
Warfarin-Gruppe bei 2 Patienten
(2%) zu schweren Blutungen gekom-
men. Blutungen allgemein traten bei
45 Patienten (27%) der Dabigatran-
bzw. 10 Patienten (12%) der Warfa-
rin-Gruppe auf (Hazard Ratio 2,45;
95%-Konfidenzintervall 1,23–4,86;
p=0,01). Die meisten thrombemboli-
schen und alle schweren Blutungs-
Ereignisse unter Dabigatran fanden
sich bei Patienten, deren Klappen-
implantation maximal 7 Tage
zurücklag (Population A).
Fazit
Dabigatran scheint derzeit keine
Alternative zu Warfarin, wenn es um
die Antikoagulation von Patienten
mit künstlicher Herzklappe geht, fol-
gern die Autoren. Eine Erklärung für
dieses ungünstige Ergebnis könnte
der Mechanismus der Thrombusbil-
dung bei Kunstklappen sein. Mögli-
cherweise sind die geschilderten
Ergebnisse auch relevant für die
Untersuchung der direkten Faktor-
Xa-Inhibitoren in dieser Indikation.
Sponsoring: Die Studie wurde von
Boehringer Ingelheim finanziert.
Dr. med. Elke Ruchalla
Der Beitrag ist erstmals erschienen in der
Deutschen Medizinischen Wochenschrift
(Dtsch Med Wochenschr 2014; 139: 9).
Alle Rechte vorbehalten.
Als Herzklappenersatz können mechanische oder biologische Klappen eingesetzt werden. Nachteil der
mechanischen Klappen ist die notwendige lebenslange Antikoagulation, dafür sind sie dauerhafter als
biologische Klappen. Die bisher überwiegend eingesetzten Vitamin-K-Antagonisten bringen zahlreiche
Einschränkungen mit sich. Für den neueren Gerinnungshemmer Dabigatran gibt es nun aktuelle Daten.
N Engl J Med 2013; 369: 1206–1214
Kardiologie
Herzklappenersatz:
Vermehrte Thrombembolien unter Dabigatran
Der Einsatz von Dabigatran bei Patienten mit mechanischen Herzklappen zeigte in dieser
Studie gegenüber Warfarin keinen Vorteil, sondern ein erhöhtes Risiko, so die Autoren.
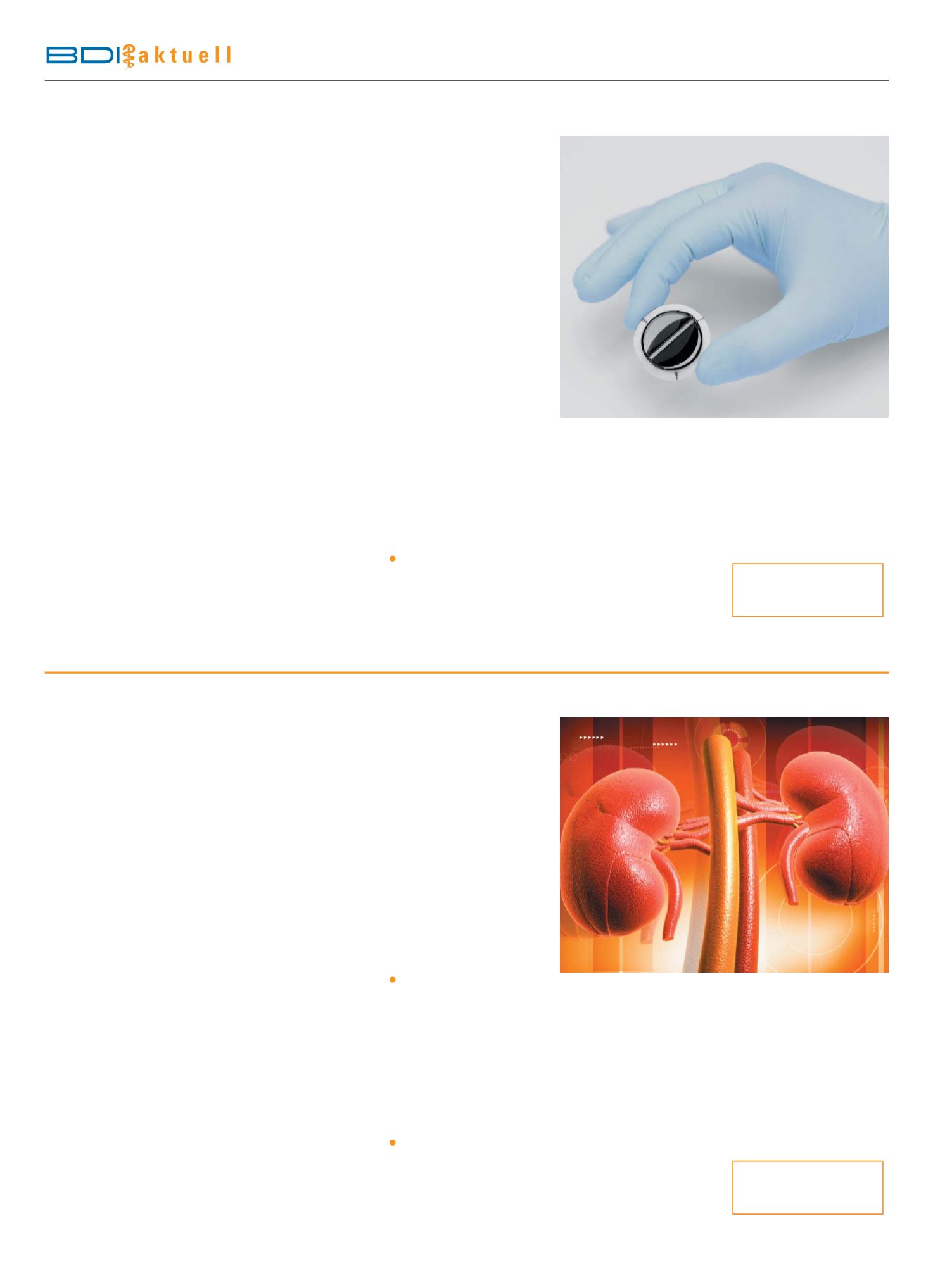
Bild: künstliche Herzklappe (Quelle: ingenium-design.de / Fotolia).
Weltweit nahmen 157 Kliniken mit
insgesamt 1452 Patienten mit einem
Typ-2-Diabetes an der doppelblinden
Nichtunterlegenheitsstudie teil. Bei
den Patienten hatte Metformin (min-
destens 10 Wochen) nicht zu einer
ausreichenden metabolischen Kon-
trolle geführt. Das HbA
1c
betrug
7–9,5%. 482 Patienten erhielten
zusätzlich zu Metformin den Sulfo-
nylharnstoff Glimepirid (6–8 mg
täglich), 483 bekamen 100 mg Cana-
gliflozin und 485 nahmen täglich
300 mg Canagliflozin ein. Metformin
wurde in unveränderter Dosis weiter
verordnet. Der primäre Studienend-
punkt war der HbA
1c
-Wert nach
52 Wochen.
Bezüglich der Absenkung des HbA
1c
war 100 mg Canagliflozin Glimepirid
nicht unterlegen, 300 mg Canagliflo-
zin war Glimepirid überlegen
(Kleinstquadrat-Mittelwert-Differenz
-0,01% [100 mg] und -0,12% [300
mg]). HbA1c-Werte <7,0% und <6,5%
wurden in vergleichbarer Häufigkeit
erzielt. Der Nüchternblutzucker
wurde mit Canagliflozin dauerhaft
gesenkt, während bei Glimepirid
nach 18 Wochen ein Anstieg zu ver-
zeichnen war. Hypoglykämische Epi-
soden kamen in den Canagliflozin-
Gruppen signifikant seltener vor
(jeweils p<0,0001). Das Körperge-
wicht stieg unter Glimepirid leicht
an, unter Canagliflozin kam es zu
einer signifikanten Reduktion
(p<0,0001). Eine Substudie belegte,
dass zwei Drittel der Gewichtsab-
nahme das Körperfett betrafen, dabei
stärker die viszeralen als die subku-
tanen Anteile. Canagliflozin senkte
den Blutdruck, erhöhte das HDL-
Cholesterin und reduzierte Triglyce-
ride stärker als Glimepirid.
Die Komplikationsraten der Gruppen
waren insgesamt vergleichbar.
Hauptnebenwirkungen von Canagli-
flozin waren Harnwegsinfekte und
genitale Pilzinfektionen. Weitere
Komplikationen waren Diurese-asso-
ziiert (Pollakisurie, Polyurie, ortho-
statische Hypotension). Die Serum-
elektrolyte wurden nicht beeinflusst.
Beobachtet wurde eine Abnahme der
Leberenzyme und ein Anstieg von
Hämoglobin, Bilirubin und Serum-
Harnstoff unter Canagliflozin vergli-
chen mit Glimepirid.
Fazit
Als Ergänzung zu Metformin war der
SGLT2-Inhibitor Canagliflozin dem
Sulfonylharnstoff Glimepirid nicht
unterlegen und wurde von den
Patienten gut vertragen. Diese Ergeb-
nisse befürworten den Einsatz von
Canagliflozin bei Patienten, die unter
Metformin keine ausreichende glykä-
mische Kontrolle erzielen, so die
Autoren.
Kommentar zur Studie
Die Ergebnisse für Canagliflozin
seien zwar ermutigend, insbesondere
hinsichtlich der geringen Hypoglykä-
mierate und der Gewichtsreduktion.
SGLT2-Inhibitoren behandelten aber
mit der Glukosurie letztlich ein
Symptom und nicht die Grunder-
krankung. Eine Krankheitsmanifesta-
tion werde damit zur therapeuti-
schen Option. Durch die Abnahme
der glomerulären Filtrationsrate im
Verlauf des Diabetes sei zudem mit
einer Wirkungsabschwächung zu
rechnen, kommentieren M. Diamant
und L. M. Morsink.
Lancet 2013; 382: 917–918
Sponsoring: Die Studie wurde von
Janssen Research & Development
finanziell unterstützt.
Dr. med. Susanne Krome
Der Beitrag ist erstmals erschienen in der
Deutschen Medizinischen Wochenschrift
(Dtsch Med Wochenschr 2013; 138:
2337). Alle Rechte vorbehalten.
Der Insulin-unabhängige SGLT2-Inhibitor Canagliflozin verringert die renale Glukoseresorption und
erhöht dadurch die Glukoseausscheidung bei Patienten mit Diabetes mellitus. Cefalu et al. verglichen
nun in der CANTATA-SU-Studie Canagliflozin mit dem Sulfonylharnstoff Glimepirid als Ergänzung zu
Metformin.
Lancet 2013; 382: 941–950
Diabetologie
Canagliflozin senkt den Nüchternblutzucker
mehr als Glimiperid
Canagliflozin verringert die renale Glukoseresorption und erhöht dadurch die Glukose-
ausscheidung bei Diabetes mellitus. Als Ergänzung zu Metformin war der SGLT2-Inhibitor
Canagliflozin dem Sulfonylharnstoff Glimepirid nicht unterlegen und wurde von den
Patienten gut vertragen, so die Autoren (Bildquelle/Fotograf: Fotolia/krishnacreations).


