Medizin
Nr. 2 • Februar 2014
10
Eine 45-jährige, bislang gesunde
Patientin wurde stationär nephrolo-
gisch eingewiesen zur Abklärung mas-
siver Schwellungen beider Füße sowie
der Unter- und Oberschenkel beidseits.
Die Wassereinlagerungen im Bereich
der unteren Extremitäten begannen
vor ca. 6 Wochen und waren schnell
progredient. Es kam zu einer
Gewichtszunahme von 8 kg. Die Diure-
se war stabil, keine Makrohämaturie,
kein Schäumen des Urins. Die körperli-
che Belastbarkeit war seit 4 Wochen
etwas reduziert, aber im Alltag ausrei-
chend; erst auf gezielte und wieder-
holte Nachfrage wurde ein gelegentli-
ches thorakales Engegefühl ohne rele-
vante Belastungsdyspnoe bei starker
körperlicher Aktivität angegeben.
Bis auf eine Hysterektomie bei Myom
keine Vorerkrankungen bekannt; ins-
besondere kein Krampfleiden und
keine dermatologischen oder ophthal-
mologischen Besonderheiten; keine
erblichen Krankheiten bei Verwandten
1. Grades. Kein Nikotin- oder Alkohol-
konsum. Eine orale Kontrazeption
wurde über insgesamt 10 Jahre einge-
nommen.
Körperlicher Untersuchungsbefund
Normgewichtige Patientin (171 cm,
69 kg) mit Ödemen beider Unter- und
Oberschenkel Grad 3, RR 132/80
mmHg, Puls 72/min, regelmäßige Ak-
tion. Keine Halsvenenstauung. Kein
Exanthem, kein Enanthem, keine Café-
au-lait-Flecke, keine gingivalen Fibro-
me oder dentalen Pits. Pulmonal beid-
seits vesikuläres Atemgeräusch, keine
Rasselgeräusche, keine Klopfschall-
dämpfung, Lungengrenzen altersent-
sprechend verschieblich. Kein vitien-
typisches Herzgeräusch. Abdominaler
Untersuchungsbefund unauffällig, ins-
besondere keine Resistenz oder Tumor
palpabel. Nierenlager beidseits ohne
Klopfschmerz. Periphere Pulse seiten-
gleich tastbar.
Klinisch-chemische Untersuchungen
Normalwerte für Serumelektrolyte,
Serum-Kreatinin 0,82 mg/dl, Harnstoff
21 mg/dl. Transaminasen, LDH und
CRP im Normbereich. Unauffälliges
Differenzial-Blutbild; Gerinnungspara-
meter normal.
Serumelektrophorese:
Albuminkonzen-
tration mit 2,4 g/dl vermindert (56,8%
des Gesamteiweißes), übrige Eiweiß-
fraktionen unauffällig.
Kapilläre Blutgasanalyse:
pO
2
80 mmHg, pCO
2
38 mmHg,
HCO
3
- 25 mmol/l, pH 7,42, SO
2
96%.
Urindiagnostik:
Mikroalbuminurie
(52 mg/24 h), keine Erythrozyturie,
keine Akanthozyten, kein Infekt, keine
Zylinder.
Ergänzende Untersuchungen
Echokardiographie:
normale links- und
rechtsventrikuläre Funktion, kein Viti-
um, kein Perikarderguss, kein Hinweis
auf Kardiomyopathie.
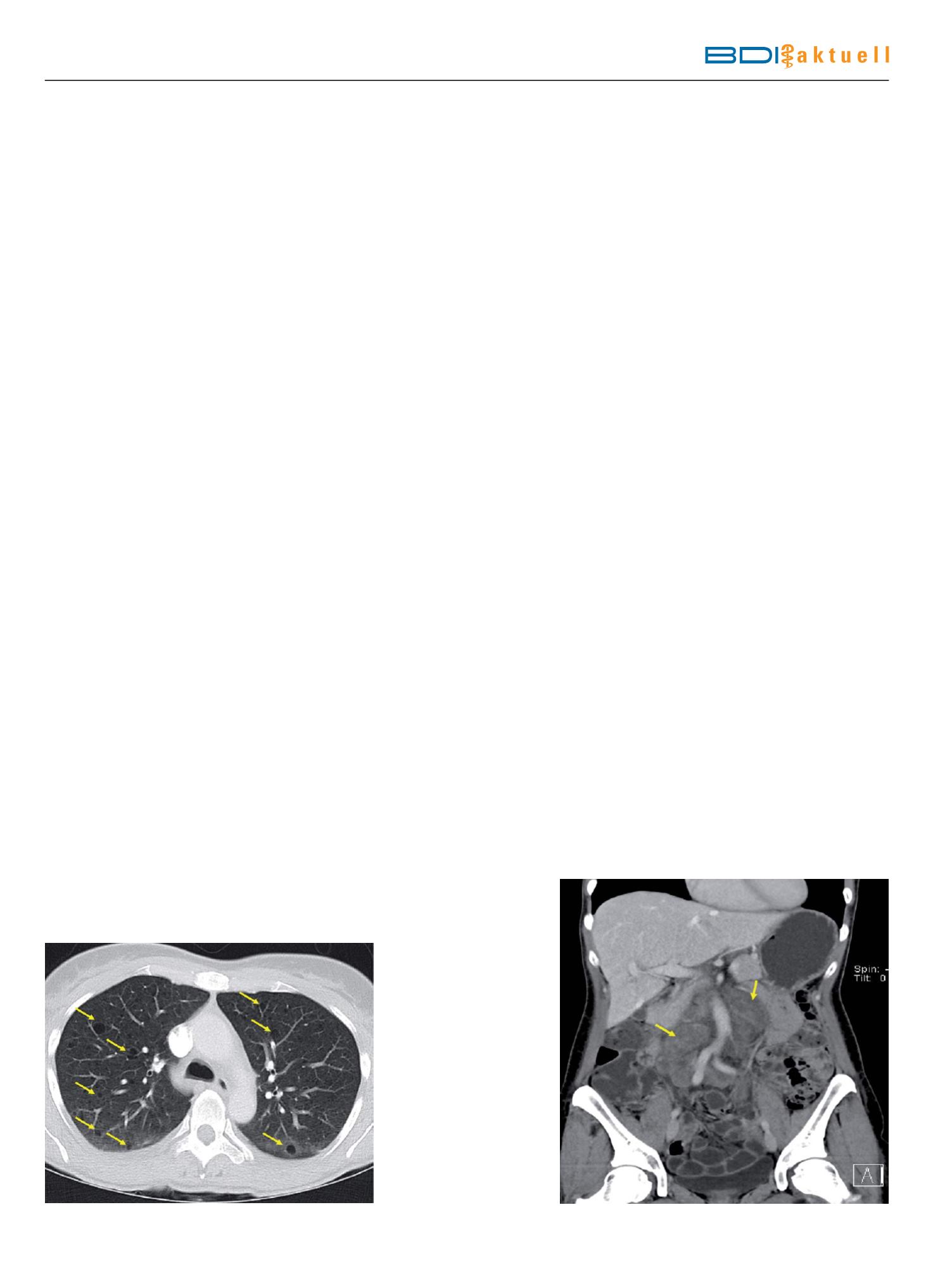
Computertomographie des Thorax:
Diffus multiple kleinzystische Lungen-
veränderungen beidseits (Abb. 1).
Kernspintomographie des Abdomens:
Ausgedehnte retroperitoneal (paraka-
val und paraaortal) gelegene, noduläre
Läsionen (Querdurchmesser 4,4 cm,
Längsdurchmesser ca. 10 cm), kräftig
Kontrastmittel anreichernd. Kein
Nachweis von Angiomyolipomen der
Nieren (Abb. 2).
Lungenfunktionsanalyse:
Vitalkapazität
3,5 l (95% des Solls), FEV
1
95% des
Solls, DLCO 51% des Solls.
Histomorphologie und Immunhistoche-
mie der retroperitonealen Biopsien:
Epi-
theloide und spindelzellige Proliferati-
on mit immunhistologisch positiver
Reaktion auf glattmuskuläres Aktin,
den Endothelmarker CD31 und den
Lymphendothelmarker D2–40 (Abb. 3;
somit passend zu einer LAM.
Diagnose, Therapie und Verlauf
Die laborchemischen und echokardio-
graphischen Befunde ergaben keinen
Hinweis auf eine kardiale, renale oder
hepatische Ursache der Ödeme. Die
Hypalbuminämie reichte als pathoge-
netische Erklärung für die massive
Ödembildung nicht aus. Zur Klärung
eines Abflusshindernisses erfolgte eine
Bildgebung mittels CT. Hierbei wurden
ausgedehnte retroperitoneale Massen
eines Lymphangioleiomyoms und die
für die Erkrankung typischen pulmo-
nalen Zystenbildungen nachgewiesen.
Die Diagnose wurde histomorpholo-
gisch und immunhistologisch durch
Biopsieproben der retroperitonealen
Formationen bestätigt. Die Ödeme der
unteren Extremitäten waren durch
mechanisch gestörten Lymphabfluss
bedingt. Bei negativer Familienanam-
nese ist von einer sporadischen LAM
auszugehen. Hinweise auf eine tuberö-
se Sklerose (TS) als zugrundeliegende
Erkrankung ergaben sich weder kli-
nisch noch durch eine nachfolgende
zerebrale MRT-Untersuchung. Die
leicht- bis mittelgradige Diffusionsstö-
rung der Lunge führte bislang nicht zu
einer wesentlichen subjektiven Beein-
trächtigung der Patientin unter All-
tagsbedingungen. Unter stationären
Bedingungen konnte unter milder diu-
retischer Therapie mit Hydrochlorot-
hiazid und Bilanzierung eine Rückbil-
dung der Ödeme erreicht werden. Die
Hypalbuminämie war reversibel und
ist nicht sicher im Rahmen der LAM
erklärbar. Derzeit wird die Möglichkeit
einer Therapie mit Rapamycin zur Pro-
gressionsverlangsamung des Wachs-
tums der LAM und des Lungenfunkti-
onsverlusts geprüft.
Diskussion
Die LAM ist eine genetisch bedingte
Erkrankung, die sich vorzugsweise bei
Frauen im gebärfähigen Alter manifes-
tiert und mit progressiver Zerstörung
des Lungengewebes, typischer pulmo-
naler Zystenbildung und progressiver
respiratorischer Insuffizienz einher-
geht. Durch Ruptur der Zysten kann es
zum Pneumothorax oder zu Hämopty-
sen kommen. Typische extrapulmonale
Befunde umfassen abdominale und
thorakale Lymphangiome, Behinde-
rung des Lymphabflusses durch gestör-
te Lymphgefäße mit Entwicklung eines
Chylothorax oder chylösen Ascites.
Renale Manifestationen der LAM sind
Angiomyolipome, die bei Größenzu-
nahme ein Blutungsrisiko darstellen
können. Auch in Leber und Milz kön-
nen Angiomyolipome auftreten.
In ca. 40% tritt die LAM im Rahmen
des „Tuberöse-Sklerose-Komplexes“
auf (TSC-LAM) [6]. Die tuberöse Skle-
rose (TS) ist eine autosomal dominant
vererbte Erkrankung, die mit glioneu-
ralen Hamartomen, Epilepsie, kogniti-
ver Beeinträchtigung und typischen
Hautveränderungen mit Angiofibro-
men und Fibromen des Nagelfalzes
(„Koenen Tumore“) einhergeht.
Zugrunde liegen Mutationen des TSC-
1- oder TSC-2-Suppressor-Gens, die
für das Protein Hamartin (TSC-1) oder
Tuberin (TSC-2) kodieren. Der Hamar-
tin-Tuberin-Komplex steuert Zell-
wachstum und Proliferation durch
Suppression des „mammalian target of
rapamycin“ (mTOR) [4]. Bei Patienten
mit einer TS ist aufgrund der häufigen
Assoziation mit einer LAM eine geziel-
te Screening-Diagnostik mit High-
Resolution-CT-Thorax zum frühzeiti-
gen Erkennen zystischer Lungenverän-
derungen sinnvoll [1]. Bei unserer
Patientin fehlten TS-typische kutane
Symptome und Fibrombildungen. Eine
Schädel-MRT-Untersuchung ergab kei-
nen Hinweis auf intrakranielle Tumore
oder Meningiome. Die Familienanam-
nese war hinsichtlich des Auftretens
einer LAM und einer Phakomatose
leer. Somit ist von einer sporadischen
LAM auszugehen.
Die Besonderheit unseres klinischen
Fallberichts liegt in der ungewöhnli-
chen Erstmanifestation der LAM mit
relativ schnell auftretenden Ödemen
der unteren Extremitäten bei einer bis
dahin weitgehend gesunden Frau.
Meist sind pulmonale Beschwerden,
wie Dyspnoe (42%), Pneumothorax
(43%), Husten (14%), Brustschmerzen
(14%) oder Hämoptysen (14%) die füh-
renden Erstsymptome einer LAM [2].
Die pulmonale Symptomatik war bei
unserer Patientin subjektiv nicht
bedeutsam und wurde erst nach
gezieltem Nachfragen in diskreter Aus-
prägung geschildert. Zur Klärung einer
unteren Einfluss-Stauung als Ursache
einer Ödembildung der unteren Extre-
mitäten ist eine bildgebende Diagnos-
tik mittels CT und/oder MRT etabliert.
Häufig finden sich retroperitoneale
Raumforderungen wie Lymphome,
gynäkologische Tumore sowie Metas-
tasen mit Einwachsen in die V. cava
inferior oder den Ductus thoracicus
mit hämodynamischer Störung des
Venenflusses oder des Lymphflusses.
Die typische Kontrastmittelanreiche-
rung der ausgedehnten parakavalen
Raumforderungen, die durch Kompres-
sion zu einer Störung des Blut- und
Lymphflusses führten, leiteten bei
unserer Patientin zu der Diagnose
einer LAM. Diese wurde histologisch
durch eine CT-gesteuerte Biopsie der
retroperitonealen Formationen mit
typischem Nachweis einer Proliferati-
on glatter Muskelzellen und Neubil-
dungen von Lymphgefäß-Endothelzel-
len bestätigt. Überdies war der radiolo-
gische Befund der Lunge mit Nachweis
multipler Zysten pathognomonisch für
eine LAM. Nach den Richtlinien der
European Respiratory Society ist das
Vorhandensein vieler ( > 10) bipulmo-
naler Zysten mit einer Ausdehnung
von 2–30 mm bei ansonsten norma-
lem Lungengewebe ohne Hinweise auf
eine interstitielle Lungenerkrankung
das zentrale Diagnosekriterium für die
LAM [3].
Die Prognose von Patienten mit einer
LAM ist insbesondere wegen pulmona-
ler Komplikationen ernst; die 5-Jahres-
Mortalität beträgt bis zu 40% [7].
Patienten mit einer LAM sollten, insbe-
sondere bei Vorhandensein respiratori-
scher Symptome, eine pulmonologi-
sche Mitbetreuung erhalten. Sie sollten
hinsichtlich des möglichen Risikos für
das Auftreten eines Pneumothorax
und über mögliche Notfallmaßnahmen
aufgeklärt werden. Von einer Östro-
gen-haltigen oralen Kontrazeption
oder Hormonersatztherapie ist abzuse-
hen, da sie den Krankheitsverlauf
beschleunigen können. Eine sympto-
matische Behandlung mit inhalativen
Bronchodilatoren wird empfohlen [3].
Zur Reduktion des Volumens großer
Angiomyolipome kann der Einsatz der
antiproliferativ wirksamen Substanz
Rapamycin erwogen werden [3]. Rapa-
mycin ist ein Inhibitor des mTOR-Sig-
nalweges, der pathogenetisch bei der
LAM aktiviert ist. Es wurde gezeigt,
dass unter einer 12-monatigen Thera-
pie mit Rapamycin eine klinische Ver-
besserung und eine Stabilisierung von
Lungenfunktionsparametern (FEV
1
und FVC) erreicht wurde. Zusätzlich
kam es zu einer Verminderung der
Serumkonzentration von VEGF-D (vas-
Die pulmonale Lymphangioleiomyomatose (LAM) ist eine seltene, genetisch bedingte Erkrankung, bei der
durch neoplastisches Wachstum atypischer glatter Muskelzellen das Lungenparenchym zerstört wird.
Pathognomonisch sind pulmonale Zystenbildungen sowie thorakale und abdominale Lymphadenopathie.
Häufig führt die LAM zu respiratorischer Insuffizienz mit ungünstiger Prognose.
Kasuistik
Seltene Ursache peripherer Ödembildung:
die sporadische Lymphangioleiomyomatose
Abb.1
CT des Thorax: multiple Zysten in beiden Lungen und milchglasähnliche Trübung
des dorsalen Lungengewebes.
Abb.2
Kernspintomographie des Abdomens: paraortal ausgedehnte Raumforderungen
durch Lymphangioleiomyome.


