Basic HTML-Version

Medizin
Nr. 7 • Juli 2012
12
Sauerstoffkonzentration an den
Rezeptoren steigt, wird dieser Mecha-
nismus aufgehoben, es kommt zur
Vasodilatation und das pulmonale
Shuntvolumen nimmt ab. Dieser
Effekt kann sowohl über die Atemwe-
ge durch eine Langzeitsauerstoffthe-
rapie als auch über die Gefäße durch
Beimischung von arteriellem Blut in
den Venen erreicht werden. Dadurch
steigt im sauerstoffarmen Blut der
Pulmonalarterien der Sauerstoffgehalt
an und der erhöhte pulmonal-vasku-
läre Widerstand kann reduziert wer-
den. Über hämodynamische Effekte
bei AV-Shunts wurde bereits 1972 bei
nephrologischen Patienten berichtet
[3] (detaillierte Darstellung und Dis-
kussion möglicher pathophysiologi-
scher Mechanismen: [5]). Zur Thera-
pie der COPD werden angiologische
Eingriffe an den Iliakalgefäßen durch-
geführt. Mittels kathetergesteuerter
Perforation und Stentimplantation
wird artifiziell eine arteriovenöse Fis-
tel mit einem Durchmesser von 4 mm
geschaffen. Eine Machbarkeitsstudie
konnte zeigen, dass damit bei geeig-
neten Patienten eine Verbesserung
der Gehstrecke im 6-Minuten-Gehtest
erzielt werden kann [9]. Patienten, die
gut auf eine Sauerstoffgabe anspre-
chen, scheinen von diesem Verfahren
besser zu profitieren als O
2
-Non-Res-
ponder. Bislang aber sind die Ergeb-
nisse dieser Methode schwer vorhers-
agbar und die genauen Ein- und Aus-
schlusskriterien müssen weiter erar-
beitet werden.
Damit kann für geeignete Patienten
auch bei homogenem Lungenemphy-
sem eine erfolgversprechende Inter-
vention angeboten werden. In der
Hand eines geübten interventionellen
Angiologen ist auch diese Methode
sicher. Mögliche Komplikationen sind
selten und wenn, dann vor allem im
Bereich der Blutgefäße zu suchen:
Blutung während des Eingriffes oder
auch noch nach einem zeitlichen
Intervall, Aneurysma, Gefäßstenosen,
Ödeme. Noch ist offen, ob diese Maß-
nahme kardial zusätzlich belastend
wirkt. Einerseits entsteht eine
wesentliche Volumenmehrbelastung,
andererseits erfolgt eine Druckentlas-
tung im kleinen Kreislauf. Noch ist die
derzeitige Datenlage zu gering, um
dieses Verfahren in allgemeingültige
Empfehlungen aufzunehmen. Vor
allem gilt jede Form der Herzinsuffi-
zienz als Ausschlusskriterium und
eine sorgfältige kardiologische Eva-
luation inkl. Rechtsherzkatheter ist
prätherapeutisch obligat.
kurzgefasst
Beim homogenen Lungenem-
physem ist eine Lungenvolumenre-
duktion weniger effektiv. Unter geeig-
neten Voraussetzungen können diese
Patienten von der Anlage eines iliaka-
len AV-Shunts profitieren. Eine Arte-
rialisierung des Venenblutes wirkt der
hypoxisch bedingten pulmonalen
Vasokonstriktion entgegen und kann
das Ventilations-Perfusions-Mismatch
in der Lunge verbessern.
Fallbeispiel
Bei einer 47-jährigen Patientin mit
einem seit mehr als 5 Jahren beste-
henden heterogenen Lungenemphy-
sem mit positiver kollateraler Ventila-
tion erfolgte eine BTVA im rechten
Oberlappen: Nach 14 Tagen kam es zu
einer pneumonischen Reaktion mit
Lungeninfiltrat und typischen Symp-
tomen einer Pneumonie (Abb. 8).
Durch die erwünschte Atelektase
verbesserten sich Perfusion und
Ventilation (Abb. 9) ebenso wie die
Lungenfunktionsmesswerte und Leis-
tungsparameter. Die leichte Hyper-
kapnie mit einem pCO
2
-Wert von
50,1 mm Hg normalisierte sich.
Abb. 10 zeigt die Bodyplethysmogra-
phie vor der Therapie (unten links)
mit emphysemtypischen Kurvenver-
lauf (rot nach Anticholinergikum,
blau nach Betamimetikum). Rechts
daneben die gleiche Untersuchung
6 Monate nach der Therapie.
In den meisten Studien ist beschrie-
ben, dass Exazerbationen der COPD in
der frühen Phase nach einer BLVR
häufiger auftreten [8]. Trotz der
dadurch verursachten funktionellen
Verschlechterung sind die Ergebnisse
in den genannten Studien eindeutig
positiv. Dies zeigt aber auch, dass die
Auswahl der Patienten kritisch erfol-
gen soll und häufige Exazerbationen
sowie vermehrte Sekretbildung als
harte Ausschlusskriterien gelten müs-
sen.
Konsequenz für Klinik und Praxis
▶ Die COPD ist eine chronisch progre-
diente Erkrankung mit oft schwerer
Beeinträchtigung der Lebensquali-
tät, zudem ist sie weltweit eine der
häufigsten Todesursachen.
▶ Für eine kleine streng ausgewählte
Subgruppe von COPD-Patienten mit
einem schweren Emphysem kom-
men besondere interventionelle
Therapieverfahren in Frage.
▶ Bei geeigneten Patienten können
mit diesen Methoden Lebensquali-
tät, Lungenfunktionsparameter,
körperliches Leistungsvermögen
und wahrscheinlich auch Überleben
verbessert werden.
▶ Die meisten Erfahrungen auf die-
sem neuen Gebiet gibt es mit der
bronchoskopischen Lungenvolu-
menreduktion durch endobronchia-
le Ventilimplantation.
▶ Patienten mit schwerer COPD und
führendem Emphysem sollten des-
halb in einem pneumologischen
Zentrum vorgestellt werden, das
über geeignete differenzialdiagnos-
tische und -therapeutische Verfah-
ren verfügt und ggf. eine erfolgver-
sprechende interventionelle Thera-
pie auswählen und durchführen
kann.
Glossar
BLVR: bronchoskopische Lungen-
volumenreduktion
BTVA: bronchoskopische Thermo-
ablation (Bronchoscopic
Thermal Vapor Ablation)
COPD: chronisch obstruktive Lun-
generkrankung (chronic
obstructive pulmonary
disease)
GOLD: Global initiative for chronic
Obstructive Lung Disease
6MWT: 6-Minuten-Gehtest
(Six Minute Walk Test)
FEV
1
:
forcierte Einsekunden-
kapazität
TLCO: Transferfaktor für Kohlen-
monoxid (Transfer Factor of
the Lung for Carbon
Monoxide)
Autorenerklärung: Die Autoren
erklären, dass sie Reisekosten und
Vortragshonorare von Emphasys,
Pulmonx ROX Medical und Uptake
Medical erhalten haben. Die Klinik,
an der die Autoren tätig sind, hat
von diesen Firmen Mittel für die
Durchführung von Studien erhalten.
M. Wagner, J. H. Ficker
Medizinische Klinik 3 – Pneumologie,
Allergologie, Schlafmedizin, Klinikum
Nürnberg
Korrespondenz
Dr. Manfred Wagner
Medizinische Klinik 3 – Pneumologie.
Allergologie, Schlafmedizin, Klinikum
Nürnberg
Prof.-Ernst-Nathan-Str. 1
90419 Nürnberg
e-Mail: manfred.wagner@klinikum-
nuernberg.de
Die Literatur zum Beitrag finden Sie auf
den Seiten von BDI aktuell (www.bdi.de)
Der Beitrag ist erstmals erschienen in der
Deutschen Medizinischen Wochenschrift
(Dtsch Med Wochenschr 2012; 137: 594–
600). Alle Rechte vorbehalten.
Abb. 10
Funktionsparameter und Bodyplethysmographie vor und nach BTVA.
Links: vor Therapie mit emphysemtypischen Kurvenverlauf (rot nach Anticholinergikum,
blau nach Betamimetikum). Rechts: 6 Monate nach Therapie.
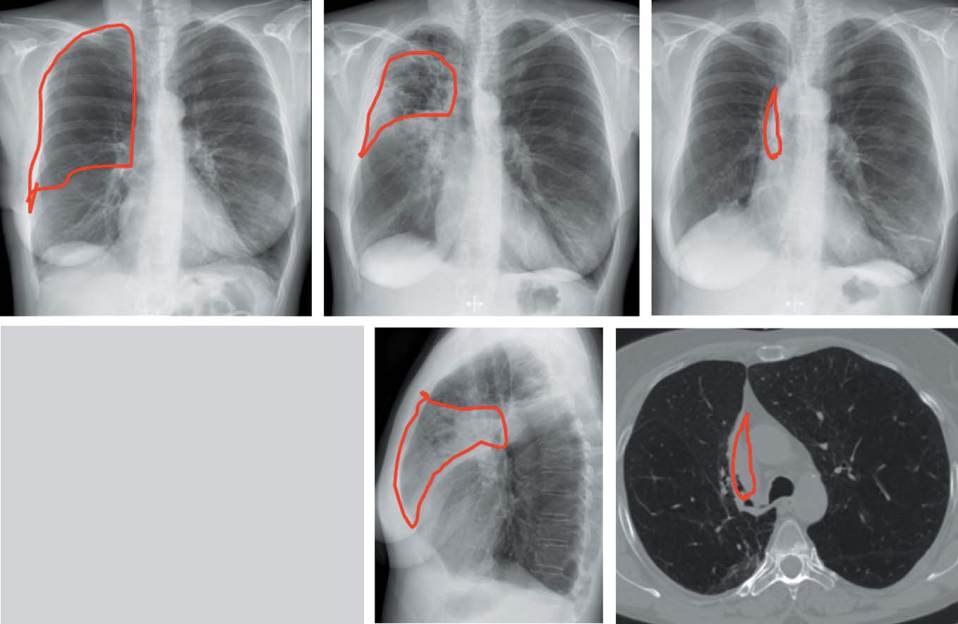
Abb. 8
Radiologischer Verlauf bei der 47-jährigen Patientin (s. Fallbeispiel). Links: vor BTVA, Mitte: 14 Tage nach BTVA, rechts: 3 Monate
nach BTVA. Lungeninfiltrat als Zeichen der lokal begrenzten Entzündungsreaktion innerhalb der ersten 30 Tage, danach Atelektasenbil-
dung. BTVA = bronchoskopische thermische Dampfablation.
FEV
1
(%)
RV (%)
FEV
1
(ml)
pCO
2
mmHg
Gewicht (kg)
6MWT (m)
23
364
610
50,1
57
350
vorher
38
249
1000
40,3
60
404
nach 3 Monaten
42
251
920
43,7
55
415
nach 6 Monaten
2,0
1,5
1,0
0,5
0,0
–0,5
–1,0
–1,5
–2,0
2,5
2,0
1,5
1,0
0,5
0,0
–0,5
–1,0
–1,5
–2,5
–2,0
Verschiebevolumen (ml)
Fluss (l/s)
Munddruck (kPa)
2,0
1,5
1,0
0,5
0,0
–0,5
–1,0
–1,5
–2,0
2,5
2,0
1,5
1,0
0,5
0,0
–0,5
–1,0
–1,5
–2,5
–2,0
Verschiebevolumen (ml)
Fluss (l/s)
Munddruck (kPa)
1
3
2
Abb. 9
Szintigrafische Veränderung der Perfusion und Ventilation nach BTVA.
Links Perfusion, rechts Ventilation, oben vor, unten 6 Monate nach BTVA. Die Perfusion
stieg von 1,66 auf 6,25 %, die Ventilation von 2,72 auf 9,89 % an.

